Удельная температура плавления алюминия
Какая температура плавления алюминия по Цельсию
 Такой металл, как алюминий, очень распространен в мире. Немалое его количество содержится в организме человека, а уж в окружающем мире его еще больше. Среди материалов, из которых построены дома, а также в конструкции любого автомобиля есть некая доля алюминия.
Такой металл, как алюминий, очень распространен в мире. Немалое его количество содержится в организме человека, а уж в окружающем мире его еще больше. Среди материалов, из которых построены дома, а также в конструкции любого автомобиля есть некая доля алюминия.
Нередко из этого вещества изготавливаются детали мебели. И если вдруг что-то из этого сломается, то можно либо приобрести новый товар в соответствующем магазине, либо заняться самостоятельным ремонтом изделия. В последнем случае придется плавить металл в домашних условиях, а для этого уже нужно знать о некоторых свойствах этого металла.
Для изготовления какой-либо алюминиевой конструкции вовсе не обязательно подробно изучать все характеристики вещества, но на основные моменты следует обратить свое внимание, включая знание, при какой температуре плавится алюминий.
О температуре плавления
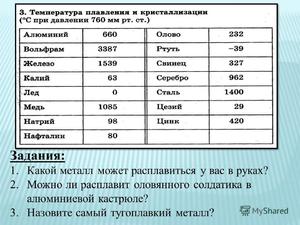
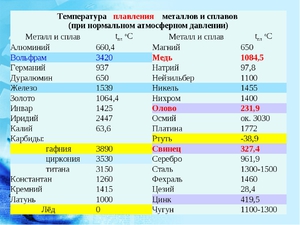
Необходимо помнить: алюминий очень легко поддается литью и начинает превращаться в жидкую субстанцию уже при температуре в 660 градусов. Для того чтобы понять, что этот показатель довольно низкий, достаточно сравнить его с температурами плавления других металлов, которые также нередко используются для изготовления тех или иных, нужных в обиходе предметов.
Например:
- сталь начинает плавиться лишь при температуре в 1300 градусов;
- чугун — при 1100 градусах.
Но все же, хоть температура плавления алюминия по Цельсию и не слишком высока по сравнению со многими другими металлами, достичь 600 градусов в домашних условиях с использованием обыкновенной газовой или электрической плиты довольно трудно.
Уменьшение температуры
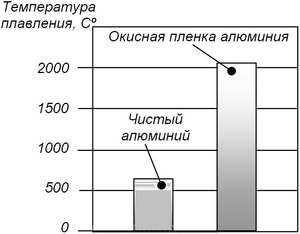
 Прежде чем подвергать металл плавлению, можно специальными методами уменьшить его температуру плавления, например, использовать в виде порошка. В этом случае он начнет плавиться чуть быстрее. Но при этом он становится опасным, так как взаимодействуя с атмосферным кислородом, может окислиться или воспламениться. А в результате окисления, как мы помним из школьного курса химии, образуется оксид алюминия; и температура, при которой начинает плавиться это вещество, уже превышает две тысячи градусов.
Прежде чем подвергать металл плавлению, можно специальными методами уменьшить его температуру плавления, например, использовать в виде порошка. В этом случае он начнет плавиться чуть быстрее. Но при этом он становится опасным, так как взаимодействуя с атмосферным кислородом, может окислиться или воспламениться. А в результате окисления, как мы помним из школьного курса химии, образуется оксид алюминия; и температура, при которой начинает плавиться это вещество, уже превышает две тысячи градусов.
Вообще избежать образования оксида не получится, если заниматься плавлением алюминия, но уменьшить количество лишнего вещества вполне возможно. При плавлении алюминия нужно не допускать попадания в вещество воды. Ведь если это случится, то произойдет взрыв.
Перед началом процесса нужно убедиться в том, что сырье является абсолютно сухим. Чаще всего в качестве исходного материала применяется алюминиевая проволока. Предварительно ее нужно с помощью ножниц разделить на множество мелких по длине кусочков. А для того, чтобы уменьшить площадь контакта с содержащимся в атмосфере кислородом, эти кусочки прессуются пассатижами.
Не всегда есть необходимость создать алюминиевое изделие высокого качества, поэтому вовсе не обязательно всегда использовать порошок или мелко нарезанную и плотно сдавленную проволоку. Можно взять любой предмет, который уже был использован, например, банку, в которой хранились консервы. Но перед плавкой нужно лишить ее нижнего шва или обрезать профиль. Полученное сырье может быть окрашено или испачкано. Не нужно об этом беспокоиться. Все, что имеется лишнее на поверхности, быстро отходит в виде шлаков.
Процесс плавления в домашних условиях
Плавление — это довольно опасный процесс. Предварительно необходимо обязательно побеспокоиться о средствах защиты от различных ядовитых веществ, которые будут образовываться, а также подготовить литейную форму.
Средства защиты
 Не обойтись без специальных перчаток даже в том случае, если расплавить алюминий необходимо лишь единожды. Это, пожалуй, основное средство защиты, так как расплавленная масса с большой долей вероятности может попасть на руки, и тогда неминуемо на коже появится ожог, поскольку температура жидкого металла превышает 600 градусов.
Не обойтись без специальных перчаток даже в том случае, если расплавить алюминий необходимо лишь единожды. Это, пожалуй, основное средство защиты, так как расплавленная масса с большой долей вероятности может попасть на руки, и тогда неминуемо на коже появится ожог, поскольку температура жидкого металла превышает 600 градусов.- Следующая часть тела, которую также необходимо защитить от попадания горячего алюминия — глаза. При частой плавке не обойтись без специальной защитной маски, ну или хотя бы очков. Но лучше всего работать в костюме, который устойчив к воздействию высокой температуры в несколько сотен градусов.
- Если необходимо получить чистый алюминий, потребуется рафинирующий флюс. И тогда работать нужно в химическом респираторе.
Выбор формы для литья
 Для того, чтобы отлить алюминий, необязательно запасаться литейной формой. Достаточно лишь приобрести лист из более тугоплавкого металла — из стали, вылить на него расплавленный алюминий и подождать, пока последний затвердеет. Но для получения какой-либо детали из алюминия обязательно придется приобретать форму для литья.
Для того, чтобы отлить алюминий, необязательно запасаться литейной формой. Достаточно лишь приобрести лист из более тугоплавкого металла — из стали, вылить на него расплавленный алюминий и подождать, пока последний затвердеет. Но для получения какой-либо детали из алюминия обязательно придется приобретать форму для литья.
Ее можно изготовить самостоятельно в домашних условиях. Для этой цели обычно используется скульптурный гипс. Он заливается в форму, затем какое-то время охлаждается. После этого в него вставляют модель и сверху кладут вторую емкость с гипсом. При этом важно не забыть проделать отверстие в гипсе с помощью какого-нибудь предмета цилиндрической формы. Через это отверстие и будет заливаться горячий алюминий.
При плавлении алюминия не обойтись без так называемого тигеля: то есть емкости из тугоплавкого металла. Она может быть выполнена из фарфора, кварца, стали, чугуна. Впрочем, изготавливать тигель самостоятельно вовсе не обязательно, ведь его можно просто купить в специальном магазине. Объем тигеля зависит от того, какое количество металла требуется получить.
Кратко о процессе
 Плавка алюминия в домашних условиях — это не такой уж трудный процесс, которым он может показаться поначалу. Кусочки металла нагреваются до нужной температуры плавки алюминия в специальной емкости.
Плавка алюминия в домашних условиях — это не такой уж трудный процесс, которым он может показаться поначалу. Кусочки металла нагреваются до нужной температуры плавки алюминия в специальной емкости.
Некоторое время полученный расплав необходимо выдерживать в разогретом состоянии и периодически удалять с его поверхности образующийся шлак. После этого чистый жидкий металл наливается в специальную форму, в которой он некоторое время будет остывать.
Время, которое уйдет на плавку, зависит от самой печи, а точнее от той температуры, которую она может обеспечить. Если же вместо печи используется газовая горелка, то она должна нагревать металл сверху.
Материалы, используемые в кабельной промышленности (алюминий)
Подписка на рассылку
Алюминий – химический элемент III группы периодической системыМенделеева (атомный номер 13, атомная масса 26,98154). В большинствесоединений алюминий трехвалентен, но при высоких температурах онспособен проявлять и степень окисления +1. Из соединений этого металласамое важное – оксид Al2O3.
Алюминий – серебристый-белый металл, легкий (плотность 2,7 г/см 3 ), пластичный, хороший проводник электричества и тепла, температура плавления 660 o C.Он легко вытягивается в проволоку и прокатывается в тонкие листы.Алюминий химически активен (на воздухе покрывается защитной оксиднойпленкой – оксидом алюминия. Оксид алюминия (Al2O3)надежно предохраняет металл от дальнейшего окисления. Но если порошокалюминия или алюминиевую фольгу сильно нагреть, то металл сгораетослепительным пламенем, превращаясь в оксид алюминия. Алюминийрастворяется даже в разбавленных соляной и серной кислотах, особеннопри нагревании. А вот в сильно разбавленной и концентрированнойхолодной азотной кислоте алюминий не растворяется. При действии наалюминий водных растворов щелочей слой оксида растворяется, причемобразуются алюминаты – соли, содержащие алюминий в составе аниона:
Алюминий, лишенный защитной пленки, взаимодействуют с водой, вытесняя из нее водород:
Образующийся гидроксид алюминия реагирует с избытком щелочи, образуя гидроксоалюминат:
Суммарное уравнение растворения алюминия в водном растворе щелочи имеет следующий вид:
Алюминий активно взаимодействует и с галогенами. Гидроксид алюминия Al(OH)3 – белое, полупрозрачное, студенистое вещество.
В земной коре содержится 8,8% алюминия. Это третий пораспространенности в природе элемент после кислорода и кремния и первый- среди металлов. Он входит в состав глин, полевых шпатов, слюд.Известно несколько сотен минералов Al (алюмосиликаты, бокситы, алунитыи другие). Важнейший минерал алюминия – боксит содержит 28-60%глинозема – оксида алюминия Al2O3.
В чистом виде алюминий впервые был получен датским физиком Х.Эрстедом в 1825 году, хотя и является самым распространенным металлом вприроде.
Производство алюминия осуществляется электролизом глинозема Al2O3 в расплаве криолита NaAlF4 при температуре 950oC.
Алюминий применяется в авиации, строительстве, преимущественно ввиде сплавов алюминия с другими металлами, электротехнике (заменительмеди при изготовлении кабелей и т.д.), пищевой промышленности (фольга),металлургии (легирующая добавка), алюмотермии и т.д.
Характеристики алюминия
- Плотность алюминия – 2,7*10 3 кг/м 3 ;
- Удельный вес алюминия – 2,7 г/cм 3 ;
- Удельная теплоемкость алюминия при 20 o C – 0,21 кал/град;
- Температура плавления алюминия – 658,7 o C ;
- Удельная теплоемкость плавления алюминия – 76,8 кал/град;
- Температура кипения алюминия – 2000 o C ;
- Относительное изменение объема при плавлении (дельтаV/V) – 6,6%;
- Коэффициент линейного расширения алюминия (при температуре около 20 o C) : – 22,9 *106(1/град);
- Коэффициент теплопроводности алюминия – 180ккал/м*час*град;
Оксид алюминия Al2O3
Оксид алюминия Al2O3, называемый такжеглиноземом, встречается в природе в кристаллическом виде, образуяминерал корунд. Корунд обладает очень высокой твердостью. Егопрозрачные кристаллы, окрашенные в красный или синий цвет, представляютсобой драгоценные камни – рубин и сапфир. В настоящее время рубиныполучают искусственно, сплавляя с глиноземом в электрической печи. Онииспользуются не столько для украшений, сколько для технических целей,например, для изготовления деталей точных приборов, камней в часах ит.п. Кристаллы рубинов, содержащих малую примесь Cr2O3, применяют а качестве квантовых генераторов – лазеров, создающих направленный пучек монохроматического излучения.
Корунд и его мелкозернистая разновидность, содержащая большоеколичество примесей – наждак, применяются как абразивные материалы.
Производство алюминия
Основным сырьем для производства алюминия служат бокситы, содержащие 32-60% глинозема Al2O3. К важнейшим алюминиевым рудам относятся также алунит и нефелин.Россия располагает значительными запасами алюминиевых руд. Кромебокситов, большие месторождения которых находятся на Урале и вБашкирии, богатым источником алюминия является нефелин, добываемый наКольском полуострове. Много алюминия находится и в месторожденияхСибири.
Алюминий получают из оксида алюминия Al2O3электролитическим методом. Используемый для этого оксид алюминия долженбыть достаточно чистым, поскольку из выплавленного алюминия примесиудаляются с большим трудом. Очищенный Al2O3 получают переработкой природного боксита.
Основное исходное вещество для производства алюминия – оксидалюминия. Он не проводит электрический ток и имеет очень высокуютемпературу плавления (около 2050 o C), поэтому требуется слишком много энергии.
Необходимо снизить температуру плавления оксида алюминия хотя бы до 1000 o C.Такой способ параллельно нашли француз П. Эру и американец Ч. Холл. Ониобнаружили, что глинозем хорошо растворяется в раплавленном криолите -минерале состава AlF3 .3NaF. Этот расплав и подвергают элктролизу при температуре всего около 950 o Cна алюминиевых производствах. Запасы криолита в природе незначительны,поэтому был создан синтетический криолит, что существенно удешевилопроизводство алюминия.
Гидролизу подвергают расплавленную смесь криолита Na3 [AlF6 ] и оксида алюминия. Смесь, содержащая около 10 весовых процентов Al2O3 , плавится при 960 o Cи обладает электропроводностью, плотностью и вязкостью, наиболееблагоприятствующими проведению процесса. Для дополнительного улучшенияэтих характеристик в состав смеси вводят добавки AlF3, CaF2 и MgF2. Благодаря этому проведение электролиза оказывается возможным при 950 o C.
Эликтролизер для выплавки алюминия представляет собой железныйкожух, выложенный изнутри огнеупорным кирпичем. Его дно (под),собранное из блоков спресованного угля, служит катодом. Аноды (один илинесколько) располагаются сверху: это – алюминиевые каркасы, заполненныеугольными брикетами. На современных заводах электролизерыустанавливаются сериями; каждая серия состоит из 150 и большего числаэлектролизеров.
При электролизе на катоде выделяется алюминий, а на аноде -кислород. Алюминий, обладающий большей плотностью, чем исходныйрасплав, собирается на дне эликтролизера, откуда его периодическивыпускают. По мере выделения металла, в расплав добавляют новые порцииоксида алюминия. Выделяющийся при электролизе кислород взаимодействуетс углеродом анода, который выгорает, образуя CO и CO2.
Первый алюминиевый завод в России был построен в 1932 году в Волхове.
Сплавы алюминия
Сплавы, повышающие прочность и другие свойства алюминия, получаютвведением в него легирующих добавок, таких, как медь, кремний, магний,цинк, марганец.
Дуралюмин (дюраль, дюралюминий, от названиянемецкого города, где было начато промышленное производство сплава).Сплав алюминия (основа) с медью (Cu: 2,2-5,2%), магнием (Mg: 0,2-2,7%)марганцем(Mn: 0,2-1%). Подвергается закалке и старению, частоплакируется алюминием. Является конструкционным материалом длаавиационного и транспортного машиностроения.
Силумин – легкие литейные сплавы алюминия (основа)с кремнием (Si: 4-13%), иногда до 23% и некоторыми другими элементами:Cu, Mn, Mg, Zn, Ti, Be). Изготавливают детали сложной конфигурации,главным образом в авто- и авиастроении.
Магналии – сплавы алюминия (основа) с магнием (Mg:1-13%) и другими элементами, обладающие высокой коррозийной стойкостью,хорошей свариаемостью, высокой пластичностью. Изготавливают фасонныеотливки (литейные магналии), листы, проволоку, заклепки и т.д.(деформируемые магналии).
Основные достоинства всех сплавов алюминия состоит в их малойплотностью (2,5-2,8 г/см3), высокая прочность (в расчете на единицувеса), удовлетворительная стойкость против атмосферной коррозии,сравнительная дешевизна и простота получения и обработка.
Алюминиевые сплавы применяются в ракетной технике, в авиа-, авто-,судо- и приборостроении, в производстве посуды, спорттоваров, мебели,рекламе и других отраслях промышленности.
По широте применения сплавы алюминия занимают второе место послестали и чугуна. Алюминий – одна из наиболее распространенных добавок всплавах на основе меди, магния, титана, никеля, цинка, железа. Алюминийприменяется и для алитирования (алюминирования) – насыщения поверхностистальных или чугунных изделий алюминием с целью защиты основногоматериала от окисления при сильном нагревании, т.е. повышенияжароупорности (до 1100 oC) и сопротивления атмосферной коррозии.
Удельный вес, теплопроводность и температура плавления алюминия
 Алюминий — всем известный из школьного курса химии элемент из таблицы Менделеева. В большей части соединений он проявляет трехвалентность, но в условиях высоких температур достигает некоторой степени окисления. Одним из самых важных его соединений является оксид алюминия.
Алюминий — всем известный из школьного курса химии элемент из таблицы Менделеева. В большей части соединений он проявляет трехвалентность, но в условиях высоких температур достигает некоторой степени окисления. Одним из самых важных его соединений является оксид алюминия.
Основные характеристики алюминия
 Алюминий — серебристый металл с удельным весом 2,7*10 3 кг/м 3 и плотностью 2,7 г/см 3 . Легкий и пластичный, хорош, как проводник электроэнергии, благодаря тому, что теплопроводность алюминия довольно высока — 180 ккал/м*час*град (указан коэффициент теплопроводности). Теплопроводность алюминия превышает аналогичный показатель чугуна в пять раз и железа в три раза.
Алюминий — серебристый металл с удельным весом 2,7*10 3 кг/м 3 и плотностью 2,7 г/см 3 . Легкий и пластичный, хорош, как проводник электроэнергии, благодаря тому, что теплопроводность алюминия довольно высока — 180 ккал/м*час*град (указан коэффициент теплопроводности). Теплопроводность алюминия превышает аналогичный показатель чугуна в пять раз и железа в три раза.
Благодаря своему составу, этот металл можно легко раскатать в тонкий лист или вытянуть в проволоку. При соприкосновении с воздухом на его поверхности образуется оксидная пленка (оксид алюминия), которая является защитой от окисления и обеспечивает его высокие антикоррозионные свойства. Тонкий алюминий, например, фольга или порошок этого металла мгновенно сгорают, если их нагреть до высоких температур и становятся оксидом алюминия.
Металл не особенно устойчив к агрессивным кислотам. К примеру, его можно растворить в серной или соляной кислотах даже, если они разбавленны, особенно, если их нагреть. Однако он не растворяется ни в разбавленной ни в концентрированной и при этом холодной азотной кислоте, благодаря оксидной пленке. Определенное воздействие на металл имеют водные растворы щелочей — оксидный слой растворяется и образуются соли, содержащие этот металл в составе аниона — алюминаты.
Известно, что алюминий является самым часто встречающимся металлом в природе, но впервые в чистом виде его смог получить ученый-физик из Дании Х. Эрстед еще в 1925 году XIX века. Этот металл занимает третье место по распространенности в природе среди элементов и является лидером среди металлов. 8,8% алюминия содержит земная кора. Его выявили в составе слюд, полевых шпатов, глин и минералов.
Производство и применение алюминия
 Процесс производства очень энергоемкий и поэтому первый большой завод в нашей стране был построен и запущен в XX веке. Основным сырьем для получения этого металла является оксид алюминия. Чтобы его получить, необходимо минералы, содержащие алюминий или бокситы, очистить от примесей. Далее электролитическим способом расплавляют естественный или полученный искусственным путем криолит при температуре чуть ниже 1000 ºС . Затем начинают понемногу добавлять оксид алюминия и сопутствующие вещества, необходимые для улучшения качества металла. В процессе оксид начинает разлагаться и выделяется алюминий. Чистота получаемого металла 99,7% и выше.
Процесс производства очень энергоемкий и поэтому первый большой завод в нашей стране был построен и запущен в XX веке. Основным сырьем для получения этого металла является оксид алюминия. Чтобы его получить, необходимо минералы, содержащие алюминий или бокситы, очистить от примесей. Далее электролитическим способом расплавляют естественный или полученный искусственным путем криолит при температуре чуть ниже 1000 ºС . Затем начинают понемногу добавлять оксид алюминия и сопутствующие вещества, необходимые для улучшения качества металла. В процессе оксид начинает разлагаться и выделяется алюминий. Чистота получаемого металла 99,7% и выше.
Этот элемент нашел свое применение в пищевом производстве в качестве фольги и столовых приборов, в строительстве используют его сплавы с другими металлами, в авиации, электротехнике в качестве заменителя меди для кабелей, как легирующая добавка в металлургии, алюмотермии и других отраслях.
Что такое температура плавки металлов?
 Температура плавки металлов – значение температуры нагревания металла, при которой начинается процесс перехода из исходного состояния в другое, то есть процесс противоположный кристаллизации (отвердевания), но неразрывно связаный с ней.
Температура плавки металлов – значение температуры нагревания металла, при которой начинается процесс перехода из исходного состояния в другое, то есть процесс противоположный кристаллизации (отвердевания), но неразрывно связаный с ней.
Итак, для расплавления металл нагревают извне до температуры плавки и продолжают нагревать для преодоления границы фазового перехода. Суть в том, что показатель температуры плавки означает температуру, при которой металл находится в фазовом равновесии, то есть между жидким и твердым телом. Другими словами существует одновременно, как в том, так и в другом состоянии. А для плавления нужно нагреть его больше пограничной температуры, чтобы процесс пошел в нужную сторону.
Стоит сказать о том, что только для чистых составов температура плавки постоянна. Если в составе металла находятся примеси, то это сместит границу фазового перехода, а, соответственно, и температура плавления будет другой. Это объясняется тем, что состав с примесями имеет иную кристаллическую структуру, в которой атомы взаимодейстуют между собой по-другому. Исходя из этого принципа, металлы можно разделить на:
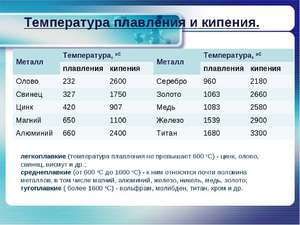
- легкого плавления, такие как ртуть и галлий, например, (температура плавки до 600°С)
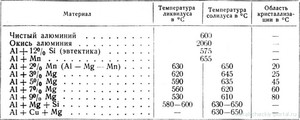
- среднеплавкие — это алюминий и медь (600-1600°С)
- тугоплавкие — молибден , вольфрам (больше 1600°С).
Знание показателя температуры плавления необходимо, как при производстве сплавов для правильного расчета их параметров, так и при эксплуатации изделий из них, поскольку этот показатель определяет ограничения их использования. Уже давным давно для удобства ученые физики свели эти данные в одну таблицу. Существуют таблицы температур плавки как металлов, так и их сплавов.
Температура плавления алюминия
 Плавление — процесс перерабатывания металлов обычно в специальных печах для получения сплава нужного качества в жидком состоянии . Как уже говорилось выше, алюминий относится к среднеплавким металлам и плавится при нагреве до 660ºС. При изготовлении изделий из металла температура плавления влияет на выбор плавильной печи или агрегата и, соответственно, используемых для отливки огнеупорных форм.
Плавление — процесс перерабатывания металлов обычно в специальных печах для получения сплава нужного качества в жидком состоянии . Как уже говорилось выше, алюминий относится к среднеплавким металлам и плавится при нагреве до 660ºС. При изготовлении изделий из металла температура плавления влияет на выбор плавильной печи или агрегата и, соответственно, используемых для отливки огнеупорных форм.
Указанная температура относится к процессу расплавки чистого алюминия. Так как в чистом виде он применяется реже, а введение в его состав примесей меняет температуру плавления. Сплавы алюминия изготавливаются для того, чтобы изменить какие-либо его свойства, увеличить прочность, например, или жароустойчивость. В качестве добавок применяют:
- цинк
- медь
- магний
- кремний
- марганец.
Добавление примесей влечет за собой снижение электропроводности, ухудшение или улучшение коррозионных свойств, повышение относительной плотности.
Обычно добавление других элементов в металл приводит к тому, что температура плавления сплава понижается, но не всегда. К примеру, добавление меди в объеме 5,7% приводит к понижению температуры плавления до 548ºС. Полученный сплав называют дюралюминием, его подвергают дальнейшей термической закалке. А алюминиево-магниевые составы плавятся при температуре 700 — 750ºС.
Во время процесса плавления необходим строгий контроль температуры расплава, а также присутствия газов в составе, которые выявляют через технологические пробы или способом вакуумной экстракции. На заключительной стадии производства сплавов алюминия проводят их модифицирование.
Алюминий, свойства, сплавы, производство
Алюминий
Алюминий – химический элемент III группы периодической системы Менделеева (атомный номер 13, атомная масса 26,98154). В большинстве соединений алюминий трехвалентен, но при высоких температурах он способен проявлять и степень окисления +1. Из соединений этого металла самое важное – оксид Al2O3.
Алюминий – серебристый-белый металл, легкий (плотность 2,7 г/см 3 ) , пластичный, хороший проводник электричества и тепла, температура плавления 660 °C. Он легко вытягивается в проволоку и прокатывается в тонкие листы. Алюминий химически активен (на воздухе покрывается защитной оксидной пленкой – оксидом алюминия.) надежно предохраняет металл от дальнейшего окисления. Но если порошок алюминия или алюминиевую фольгу сильно нагреть, то металл сгорает ослепительным пламенем, превращаясь в оксид алюминия.
- Алюминий растворяется даже в разбавленных соляной и серной кислотах, особенно при нагревании. А вот в сильно разбавленной и концентрированной холодной азотной кислоте алюминий не растворяется. При действии на алюминий водных растворов щелочей слой оксида растворяется, причем образуются алюминаты – соли, содержащие алюминий в составе аниона:
- Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] .
- Алюминий, лишенный защитной пленки, взаимодействуют с водой, вытесняя из нее водород:
- 2Al + 6H2O = 2Al(OH)3 + 3H2
- Образующийся гидроксид алюминия реагирует с избытком щелочи, образуя гидроксоалюминат:
- Al(OH)3 + NaOH = Na[Al(OH)4].
- Суммарное уравнение растворения алюминия в водном растворе щелочи имеет следующий вид:
- 2Al + 2NaOH +6H2O = 2Na[Al(OH)4] + 3H2.
- Алюминий активно взаимодействует и с галогенами. Гидроксид алюминия Al(OH)3 – белое, полупрозрачное, студенистое вещество.
- В земной коре содержится 8,8% алюминия. Это третий по распространенности в природе элемент после кислорода и кремния и первый – среди металлов. Он входит в состав глин, полевых шпатов, слюд. Известно несколько сотен минералов Al (алюмосиликаты, бокситы, алуниты и другие). Важнейший минерал алюминия – боксит содержит 28-60% глинозема – оксида алюминия Al2O3.
В чистом виде алюминий впервые был получен датским физиком Х. Эрстедом в 1825 году, хотя и является самым распространенным металлом в природе. Производство алюминия осуществляется электролизом глинозема Al2O3 в расплаве криолита NaAlF4 при температуре 950 °C. Алюминий применяется в авиации, строительстве, преимущественно в виде сплавов алюминия с другими металлами, электротехнике (заменитель меди при изготовлении кабелей и т.д.), пищевой промышленности (фольга), металлургии (легирующая добавка), алюмотермии и т.д.
Плотность алюминия, удельный вес и другие характеристики.
- Плотность – 2,7*10 3 кг/м 3 ;
- Удельный вес – 2,7 г/cм 3 ;
- Удельная теплоемкость при 20°C – 0,21 кал/град;
- Температура плавления – 658,7°C ;
- Удельная теплоемкость плавления – 76,8 кал/град;
- Температура кипения – 2000°C ;
- Относительное изменение объема при плавлении (ΔV/V) – 6,6%;
- Коэффициент линейного расширения (при температуре около 20°C) : – 22,9 *10 6 (1/град);
- Коэффициент теплопроводности алюминия – 180 ккал/м*час*град;
Модули упругости алюминия и коэффициент Пуассона
Отражение света алюминием
Числа, приведенные в таблице, показывают, какая доля света в %, падающего перпендикулярно к поверхности, отражается от нее.
ОКСИД АЛЮМИНИЯ Al2O3
Оксид алюминия Al2O3, называемый также глиноземом, встречается в природе в кристаллическом виде, образуя минерал корунд. Корунд обладает очень высокой твердостью. Его прозрачные кристаллы, окрашенные в красный или синий цвет, представляют собой драгоценные камни – рубин и сапфир. В настоящее время рубины получают искусственно, сплавляя с глиноземом в электрической печи. Они используются не столько для украшений, сколько для технических целей, например, для изготовления деталей точных приборов, камней в часах и т.п. Кристаллы рубинов, содержащих малую примесь Cr2O3, применяют а качестве квантовых генераторов – лазеров, создающих направленный пучек монохроматического излучения.
Корунд и его мелкозернистая разновидность, содержащая большое количество примесей – наждак, применяются как абразивные материалы.
ПРОИЗВОДСТВО АЛЮМИНИЯ
Основным сырьем для производства алюминия служат бокситы, содержащие 32-60% глинозема Al2O3 . К важнейшим алюминиевым рудам относятся также алунит и нефелин. Россия располагает значительными запасами алюминиевых руд. Кроме бокситов, большие месторождения которых находятся на Урале и в Башкирии, богатым источником алюминия является нефелин, добываемый на Кольском полуострове. Много алюминия находится и в месторождениях Сибири.
Алюминий получают из оксида алюминия Al2O3 электролитическим методом. Используемый для этого оксид алюминия должен быть достаточно чистым, поскольку из выплавленного алюминия примеси удаляются с большим трудом. Очищенный Al2O3 получают переработкой природного боксита.
Основное исходное вещество для производства алюминия – оксид алюминия. Он не проводит электрический ток и имеет очень высокую температуру плавления (около 2050 °C), поэтому требуется слишком много энергии.
Необходимо снизить температуру плавления оксида алюминия хотя бы до 1000 oC. Такой способ параллельно нашли француз П. Эру и американец Ч. Холл. Они обнаружили, что глинозем хорошо растворяется в раплавленном криолите – минерале состава AlF3 .3NaF. Этот расплав и подвергают элктролизу при температуре всего около 950 °C на алюминиевых производствах. Запасы криолита в природе незначительны, поэтому был создан синтетический криолит, что существенно удешевило производство алюминия.
Гидролизу подвергают расплавленную смесь криолита Na3 [AlF6 ] и оксида алюминия. Смесь, содержащая около 10 весовых процентов Al2O3 , плавится при 960 °C и обладает электропроводностью, плотностью и вязкостью, наиболее благоприятствующими проведению процесса. Для дополнительного улучшения этих характеристик в состав смеси вводят добавки AlF3, CaF2 и MgF2. Благодаря этому проведение электролиза оказывается возможным при 950 °C.
Эликтролизер для выплавки алюминия представляет собой железный кожух, выложенный изнутри огнеупорным кирпичем. Его дно (под), собранное из блоков спресованного угля, служит катодом. Аноды (один или несколько) располагаются сверху: это – алюминиевые каркасы, заполненные угольными брикетами. На современных заводах электролизеры устанавливаются сериями; каждая серия состоит из 150 и большего числа электролизеров.
При электролизе на катоде выделяется алюминий, а на аноде – кислород. Алюминий , обладающий большей плотностью , чем исходный расплав, собирается на дне эликтролизера, откуда его периодически выпускают. По мере выделения металла, в расплав добавляют новые порции оксида алюминия. Выделяющийся при электролизе кислород взаимодействует с углеродом анода, который выгорает, образуя CO и CO2.
Первый алюминиевый завод в России был построен в 1932 году в Волхове.
СПЛАВЫ АЛЮМИНИЯ
Сплавы, повышающие прочность и другие свойства алюминия, получают введением в него легирующих добавок, таких, как медь, кремний, магний, цинк, марганец.
Дуралюмин (дюраль, дюралюминий, от названия немецкого города, где было начато промышленное производство сплава). Сплав алюминия (основа) с медью (Cu: 2,2-5,2%), магнием (Mg: 0,2-2,7%) марганцем(Mn: 0,2-1%). Подвергается закалке и старению, часто плакируется алюминием. Является конструкционным материалом дла авиационного и транспортного машиностроения.
Силумин – легкие литейные сплавы алюминия (основа) с кремнием (Si: 4-13%), иногда до 23% и некоторыми другими элементами: Cu, Mn, Mg, Zn, Ti, Be). Изготавливают детали сложной конфигурации, главным образом в авто- и авиастроении.
Магналии – сплавы алюминия (основа) с магнием (Mg: 1-13%) и другими элементами, обладающие высокой коррозийной стойкостью, хорошей свариаемостью, высокой пластичностью. Изготавливают фасонные отливки (литейные магналии), листы, проволоку, заклепки и т.д. (деформируемые магналии).
Основные достоинства всех сплавов алюминия состоит в их малой плотностью (2,5-2,8 г/см3), высокая прочность (в расчете на единицу веса), удовлетворительная стойкость против атмосферной коррозии, сравнительная дешевизна и простота получения и обработка.
Алюминиевые сплавы применяются в ракетной технике, в авиа-, авто-, судо- и приборостроении, в производстве посуды, спорттоваров, мебели, рекламе и других отраслях промышленности.
По широте применения сплавы алюминия занимают второе место после стали и чугуна.
Алюминий – одна из наиболее распространенных добавок в сплавах на основе меди, магния, титана, никеля, цинка, железа.
Алюминий применяется и для алитирования (алюминирования) – насыщения поверхности стальных или чугунных изделий алюминием с целью защиты основного материала от окисления при сильном нагревании, т.е. повышения жароупорности (до 1100 °C) и сопротивления атмосферной коррозии.


 Не обойтись без специальных перчаток даже в том случае, если расплавить алюминий необходимо лишь единожды. Это, пожалуй, основное средство защиты, так как расплавленная масса с большой долей вероятности может попасть на руки, и тогда неминуемо на коже появится ожог, поскольку температура жидкого металла превышает 600 градусов.
Не обойтись без специальных перчаток даже в том случае, если расплавить алюминий необходимо лишь единожды. Это, пожалуй, основное средство защиты, так как расплавленная масса с большой долей вероятности может попасть на руки, и тогда неминуемо на коже появится ожог, поскольку температура жидкого металла превышает 600 градусов.
