Методы защиты металлов от коррозии химия
Защита металла от коррозии
Металлы используются человеком с доисторических времен, изделия из них широко распространены в нашей жизни. Самым распространенным металлом является железо и его сплавы. К сожалению, они подвержены коррозии, или ржавлению — разрушению в результате окисления. Своевременная защита от коррозии позволяет продлить срок службы металлических изделий и конструкций.

Виды коррозии
Ученые давно борются с коррозией и выделили несколько основных ее типов:
- Атмосферная. Происходит окисление вследствие контакта с кислородом воздуха и содержащимися в нем водяными парами. Присутствие в воздухе загрязнений в виде химически активных веществ ускоряет ржавление.
- Жидкостная. Проходит в водной среде, соли, содержащиеся в воде, особенно морской, многократно ускоряют окисление.
- Почвенная. Этому виду подвержены изделия и конструкции, находящиеся в грунте. Химический состав грунта, грунтовые воды и токи утечки создают особую среду для развития химических процессов.
Исходя из того, в какой среде будет эксплуатироваться изделие, подбираются подходящие методы защиты от коррозии.
Характерные типы поражения ржавчиной
Различают следующие характерные виды поражения коррозией:
- Поверхность покрыта сплошным ржавым слоем или отдельными кусками.
- На детали возникли небольшие участки ржавчины, проникающей в толщину детали.
- В виде глубоких трещин.
- В сплаве окисляется один из компонентов.
- Глубинное проникновение по всему объему.
- Комбинированные.

Виды коррозионных разрушений
По причине возникновения разделяют также:
- Химическую. Химические реакции с активными веществами.
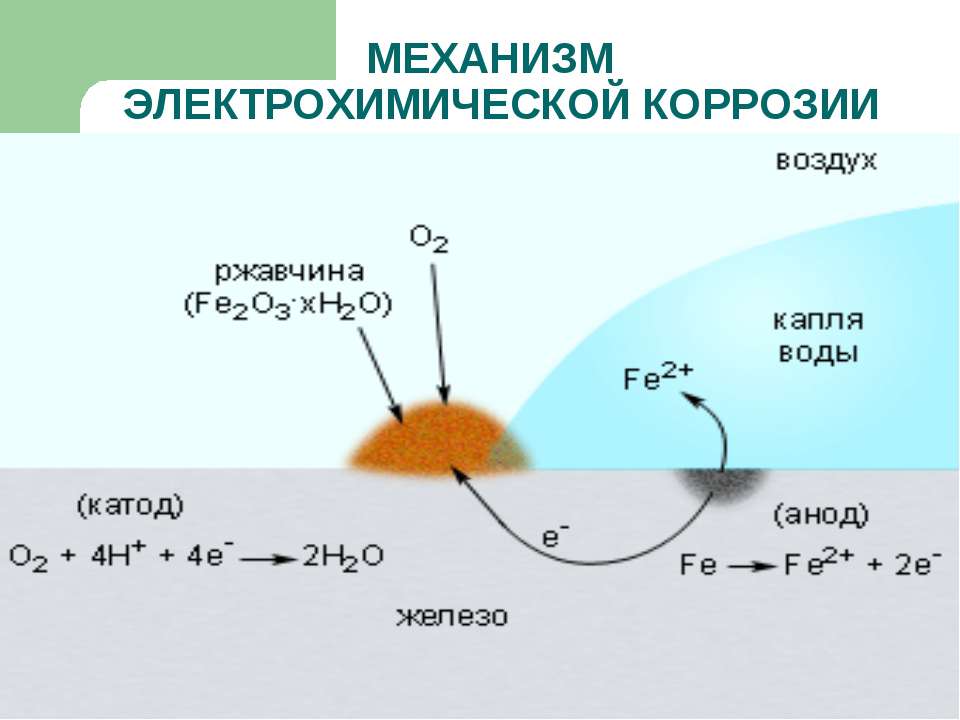
- Электрохимическую. При контакте с электролитическими растворами возникает электрический ток, под действием которого замещаются электроны металлов, и происходит разрушение кристаллической структуры с образованием ржавчины.
Коррозия металла и способы защиты от нее
Ученые и инженеры разработали множество способов защиты металлических конструкций от коррозии.
Защита от коррозии индустриальных и строительных конструкций, различных видов транспорта осуществляется промышленными способами.
Зачастую они достаточно сложные и дорогостоящие. Для защиты металлических изделий в условиях домовладений применяют бытовые методы, более доступные по цене и не связанные со сложными технологиями.
Промышленные
Промышленные методы защиты металлических изделий подразделяются на ряд направлений:
- Пассивация. При выплавке стали в ее состав добавляют легирующие присадки, такие, как Cr, Mo, Nb, Ni. Они способствуют образованию на поверхности детали прочной и химически стойкой пленки окислов, препятствующей доступу агрессивных газов и жидкостей к железу.
- Защитное металлическое покрытие. На поверхность изделия наносят тонкий слой другого металлического элемента — Zn , Al, Co и др. Этот слой защищает железо о т ржавления.
- Электрозащита. Рядом с защищаемой деталью размещают пластины из другого металлического элемента или сплава, так называемые аноды. Токи в электролите текут через эти пластины, а не через деталь. Так защищают подводные детали морского транспорта и буровых платформ.
- Ингибиторы. Специальные вещества, замедляющие или вовсе останавливающие химические реакции.
- Защитное лакокрасочное покрытие.
- Термообработка.

Порошковая покраска для защиты от коррозии
Способы защиты от коррозии, используемые в индустрии, весьма разнообразны. Выбор конкретного метода борьбы с коррозией зависит от условий эксплуатации защищаемой конструкции.
Бытовые
Бытовые методы защиты металлов от коррозии сводятся, как правило, к нанесению защитных лакокрасочных покрытий. Состав их может быть самый разнообразный, включая:
- силиконовые смолы;
- полимерные материалы;
- ингибиторы;
- мелкие металлические опилки.
Отдельной группой стоят преобразователи ржавчины — составы, которые наносят на уже затронутые коррозией конструкции. Они восстанавливают железо из окислов и предотвращают повторную коррозию. Преобразователи делятся на следующие виды:
- Грунты. Наносятся на зачищенную поверхность, обладают высокой адгезией. Содержат в своем составе ингибирующие вещества, позволяют экономить финишную краску.
- Стабилизаторы. Преобразуют оксиды железа в другие вещества.
- Преобразователи оксидов железа в соли.
- Масла и смолы, обволакивающие частички ржавчины и нейтрализующие ее.

При выборе грунта и краски лучше брать их от одного производителя. Так вы избежите проблем совместимости лакокрасочных материалов.
Защитные краски по металлу
По температурному режиму эксплуатации краски делятся на две большие группы:
- обычные, используемые при температурах до 80 °С;
- термостойкие.
По типу связующей основы краски бывают:
Лакокрасочные покрытия по металлу имеют следующие достоинства:
- качественная защита поверхности от коррозии;
- легкость нанесения;
- быстрота высыхания;
- много разных цветов;
- долгий срок службы.
Большой популярностью пользуются молотковые эмали, не только защищающие метал, но и создающие эстетичный внешний вид. Для обработки металла распространена также краска-серебрянка. В ее состав добавлена алюминиевая пудра. Защита металла происходит за счет образования тонкой пленки окиси алюминия.

Эпоксидные смеси из двух компонентов отличаются исключительной прочностью покрытия и применяются для узлов, подверженных высоким нагрузкам.
Защита металла в бытовых условиях
Чтобы надежно защитить металлические изделия от коррозии, следует выполнить следующую последовательность действий:
- очистить поверхность от ржавчины и старой краски с помощью проволочной щетки или абразивной бумаги;
- обезжирить поверхность;
- сразу же нанести слой грунта;
- после высыхания грунта нанести два слоя основной краски.
При работе следует использовать средства индивидуальной защиты:
- перчатки;
- респиратор;
- очки или прозрачный щиток.
Способы защиты металлов от коррозии постоянно совершенствуются учеными и инженерами.
Методы противостояния коррозионным процессам
Основные методы, применяемые для противодействия коррозии, приведены ниже:
- повышение способности материалов противостоять окислению за счет изменения его химического состава;
- изоляция защищаемой поверхности от контакта с активными средами;
- снижение активности окружающей изделие среды;
- электрохимические.
Первые две группы способов применяются во время изготовления конструкции, а вторые – во время эксплуатации.
Методы повышения сопротивляемости
В состав сплава добавляют элементы, повышающие его коррозионную устойчивость. Такие стали называют нержавеющими. Они не требуют дополнительных покрытий и отличаются эстетичным внешним видом. В качестве добавок применяют никель, хром, медь, марганец, кобальт в определенных пропорциях.

Нержавеющая сталь AISI 304
Стойкость материалов к ржавлению повышают также, удаляя их состава ускоряющие коррозию компоненты, как, например, кислород и серу — из стальных сплавов, а железо – из магниевых и алюминиевых.
Снижение агрессивности внешней среды и электрохимическая защита
С целью подавления процессов окисления во внешнюю среду добавляют особые составы — ингибиторы. Они замедляют химические реакции в десятки и сотни раз.
Электрохимические способы сводятся к изменению электрохимического потенциала материала путем пропускания электрического тока. В результате коррозионные процессы сильно замедляются или даже вовсе прекращаются.
Пленочная защита
Защитная пленка препятствует доступу молекул активных веществ к молекулам металла и таким образом предотвращают коррозионные явления.
Пленки образуются из лакокрасочных материалов, пластмассы и смолы. Лакокрасочные покрытия недороги и удобны в нанесении. Ими покрывают изделие в несколько слоев. Под краску наносят слой грунта, улучшающего сцепление с поверхностью и позволяющего экономить более дорогую краску. Служат такие покрытия от 5 до 10 лет. В качестве грунта иногда применяют смесь фосфатов марганца и железа.
Защитные покрытия создают также из тонких слоев других металлов: цинка, хрома, никеля. Их наносят гальваническим способом.
Покрытие металлом с более высоким электрохимическим потенциалом, чем у основного материала, называется анодным. Оно продолжает защищать основной материал, отвлекая активные окислители на себя, даже в случае частичного разрушения. Покрытия с более низким потенциалом называют катодными. В случае нарушения такого покрытия оно ускоряет коррозию за счет электрохимических процессов.
Металлическое покрытие также можно наносить также методом распыления в струе плазмы.
Применяется также и совместный прокат нагретых до температуры пластичности листов основного и защищающего металла. Под давлением происходит взаимная диффузия молекул элементов в кристаллические решетки друг друга и образование биметаллического материала. Этот метод называют плакированием.
Методы защиты металлов от коррозии химия
КОРРОЗИЯ МЕТАЛЛОВ И СПЛАВОВ
1. Коррозия (от латинского « corrodere » разъедать) – самопроизвольный окислительно-восстановительный процесс разрушения металлов и сплавов вследствие взаимодействия с окружающей средой.
2. Виды коррозии: химическая и электрохимическая
I . Химическая – коррозия, обусловленная взаимодействием металлов с веществами, содержащимися в окружающей среде, при этом происходит окислительно-восстановительное разрушение металла без возникновения электрического тока в системе.
К химической коррозии относятся:
– газовая коррозия – коррозионное разрушение под воздействием газов при высоких температурах;
– коррозия в жидкостях-неэлектролитах.
– химическая коррозия, обусловленная взаимодействием металлов с газами.
Основной окислитель – кислород воздуха.
Процессы химической коррозии железа:
2 Fe + O 2 = 2 FeO
3 Fe + 3 O 2 = FeO · Fe 2 O 3 (смешанный оксид железа ( II , III ) )
4 Fe + 3 O 2 + 6 H 2 O = 4 Fe ( OH )3 (на воздухе в присутствии влаги)
Fe ( OH )3 t ° C → H 2 O + FeOOH (ржавчина)
2 Fe + 3 Cl 2 = 2 FeCl 3
Химическая коррозия в жидкостях-неэлектролитах
Жидкости-неэлектролиты – это жидкие среды, которые не являются проводниками электричества. К ним относятся: органические (бензол, фенол, хлороформ, спирты, керосин, нефть, бензин); неорганического происхождения (жидкий бром, расплавленная сера и т.д.). Чистые неэлектролиты не реагируют с металлами, но с добавлением даже незначительного количества примесей процесс взаимодействия резко ускоряется. Например, если нефть будет содержать серу или серосодержащие соединения (сероводород, меркаптаны) процесс химической коррозии ускоряется. Если вдобавок увеличится температура, в жидкости окажется растворенный кислород – химическая коррозия усилится.
Присутствие в жидкостях-неэлектролитах влаги обеспечивает интенсивное протекание коррозии уже по электрохимическому механизму.
Химическая коррозия в жидкостях-неэлектролитах подразделяется на несколько стадий:
– подход окислителя к поверхности металла;
– хемосорбция реагента на поверхности;
– реакция окислителя с металлом (образование оксидной пленки);
– десорбция оксидов с металлом (может отсутствовать);
– диффузия оксидов в неэлектролит (может отсутствовать).
Для защиты конструкций от химической коррозии в жидкостях-неэлектролитах на ее поверхность наносят покрытия, устойчивые в данной среде.
II . Электрохимическая – окислительно-восстановительное разрушение сплавов и металлов, содержащих примеси, с возникновением электрического тока в системе.
АНОД (более активный металл) – разрушается
КАТОД (менее активный металл или примесь неметалла, способного + ē) – восстанавливается среда
Ме 0 – n ē → Me n + (процесс окисления)
кислая среда: 2 H + + 2ē → H 2 (процесс восстановления)
влажный воздух: O 2 + 2 H 2 O + 4ē → 4 OH – (процесс восстановления)
Электрохимическая коррозия железной детали с примесями меди во влажном воздухе.
А: Fe 0 – 2ē → Fe 2+ (Окисление)
К: O 2 + 2 H 2 O + 4ē → 4 OH – (процесс восстановления)
Итог: 2 Fe + O 2 + 2 H 2 O = 2 Fe ( OH )2 (белая ржавчина)
4 Fe ( OH )2 + 2 H 2 O + O 2 = 4 Fe ( OH )3 (бурая ржавчина)
1). Металлические покрытия – анодное (покрытие более активным металлом Zn , Cr ) – оцинкованное железо; катодное (покрытие менее активным металлом Ni , Sn , Ag , Au ) – белая жесть (лужёное железо) – не защищает от разрушения в случае нарушения покрытия.
2). Неметаллические покрытия – органические (лаки, краски, пластмассы, резина – гумирование, битум);
3). Протекторная защита – присоединение пластины из более активного металла ( Al , Zn , Mg ) – защита морских судов.
4). Электрохимическая (катодная) защита – соединение защищаемого изделия с катодом внешнего источника тока, вследствие чего изделие становится катодом. Ток идёт в противоположном направлении.
5). Добавление ингибиторов ( в зависимости от природы металла – NaNO 2, Na 3 PO 4, хромат и бихромат калия, ВМС органические соединения), адсорбируются на поверхности металла и переводят его в пассивное состояние.
Задания и вопросы по теме: «Коррозия металлов и сплавов»
№1. При электрохимической коррозии на поверхности анода протекает процесс
А) Восстановления ионов водорода; Б) Окисления металла;
В) Восстановление молекул кислорода; Г) Окисления молекул водорода.
№2. Почему считают, что рядом со стальной коронкой (Fе) не рекомендуется ставить золотую (Аu)?
№3. Вот история, произошедшая с норвежским грузовым судном «Анатина». Трюмы теплохода, направлявшегося к берегам Японии, были заполнены медным концентратом. Корпус судна сделан был из стали. Внезапно судно дало течь. Объясните, что произошло.
№4. Какой из компонентов загрязненного городского воздуха является наиболее коррозионно-активным по отношению к металлам, особенно при повышенной влажности:
а) N2; б) СО; в) SO2.
№5. Рассмотрите рисунок, ответьте на вопросы:
Обратите внимание! В восстановлении кислорода участвуют ионы Н + . Если концентрация Н + понижается (при повышении рН), восстановление О2 затрудняется. Замечено, что железо, находящееся в контакте с раствором, рН которого выше 9–10, не корродирует.
С усилением коррозии в присутствии солей часто сталкиваются автомобилисты в тех местностях, где в зимнее время для борьбы с гололедицей дороги обильно посыпают солью. Влияние солей объясняется тем, что образуемые ионы создают электролит, необходимый для возникновения замкнутой электрической цепи.

- Определить тип коррозии в каждом стакане.
- В каких стаканах железный гвоздь прокорродировал сильнее, в каких меньше, а в каких коррозии не подвергся? Почему?
- Объясните, что усиливает коррозию, а что ее замедляет?
№6. Рассмотрите процесс коррозии при соединении медной трубы с гальванизированной (оцинкованной) стальной трубой, если обе трубы находятся в земле.
№7. Почему цинк не используют при изготовлении консервных банок для покрытия им железа? Почему оцинкованное железо идёт на изготовления вёдер, баков?
№8. Как будет протекать процесс коррозии в том случае, если железную водосточную трубу прибить к дому алюминиевыми гвоздями?
№9. При изготовлении луженого железа (белой жести) – железо покрывают оловом, какое это покрытие – А) Анодное; Б) Катодное? Запишите электродные процессы
№10. Знаменитая Кутубская колонна в Индии близ Дели вот уже полторы тысячи лет стоит и не разрушается, несмотря на жаркий и влажный климат. Сделана она из железа, в котором почти нет примесей. Объясните, почему в данном случае статуя не подвергается коррозии
Коррозия металлов
Коррозия – разрушение поверхности сталей и сплавов под воздействием различных физико-химических факторов – наносит огромный ущерб деталям и металлоконструкциям. Ежегодно этот невидимый враг «съедает» около 13 млн. т металла. Для сравнения – металлургическая промышленность стран Евросоюза в прошлом, 2014 году произвела всего на 0,5 млн. тонн больше. И это только – прямые потери. А длительная эксплуатация стальных изделий без их эффективной защиты от коррозии вообще невозможна.
Что такое коррозия и её разновидности
Основной причиной интенсивного окисления поверхности металлов (что и является основной причиной коррозии) являются:
- Повышенная влажность окружающей среды.
- Наличие блуждающих токов.
- Неблагоприятный состав атмосферы.
Соответственно этому различают химическую, трибохимическую и электрохимическую природу коррозии. Именно они в совокупности своего влияния и разрушают основную массу металла.
Химическая коррозия
Такой вид коррозии обусловлен активным окислением поверхности металла во влажной среде. Безусловным лидером тут является сталь (исключая нержавеющую). Железо, являясь основным компонентом стали, при взаимодействии с кислородом образует три вида окислов: FeO, Fe2O3 и Fe3O4. Основная неприятность заключается в том, что определённому диапазону внешних температур соответствует свой окисел, поэтому практическая защита стали от коррозии наблюдается только при температурах выше 10000С, когда толстая плёнка высокотемпературного оксида FeO сама начинает предохранять металл от последующего образования ржавчины. Это процесс называется воронением, и активно применяется в технике для защиты поверхности стальных изделий. Но это – частный случай, и таким способом активно защищать металл от коррозии в большинстве случаев невозможно.

Химическая коррозия активизируется при повышенных температурах. Склонность металлов к химическому окислению определяется значением их кислородного потенциала – способности к участию в окислительно-восстановительных реакциях. Сталь – ещё не самый худший вариант: интенсивнее её окисляются, в частности, свинец, кобальт, никель.
Электрохимическая коррозия
Эта разновидность коррозии более коварна: разрушение металла в данном случае происходит при совокупном влиянии воды и почвы на стальную поверхность (например, подземных трубопроводов). Влажный грунт, являясь слабощёлочной средой, способствует образованию и перемещению в почве блуждающих электрических токов. Они являются следствием ионизации частиц металла в кислородсодержащей среде, и инициирует перенос катионов металла с поверхности вовне. Борьба с такой коррозией усложняется труднодоступностью диагностирования состояния грунта в месте прокладки стальной коммуникации.
Электрохимическая коррозия возникает при окислении контактных устройств линий электропередач при увеличении зазоров между элементами электрической цепи. Помимо их разрушения, в данном случае резко увеличивается энергопотребление устройств.
Трибохимическая коррозия
Данному виду подвержены металлообрабатывающие инструменты, которые работают в режимах повышенных температур и давлений. Антикоррозионное покрытие резцов, пуансонов, фильер и пр. невозможно, поскольку от детали требуется высокая поверхностная твёрдость. Между тем, при скоростном резании, холодном прессовании и других энергоёмких процессах обработки металлов начинают происходить механохимические реакции, интенсивность которых возрастает с увеличением температуры на контактной поверхности «инструмент-заготовка». Образующаяся при этом окись железа Fe2O3 отличается повышенной твёрдостью, и поэтому начинает интенсивно разрушать поверхность инструмента.

Методы борьбы с коррозией
Выбор подходящего способа защиты поверхности от образования ржавчины определяется условиями, в которых работает данная деталь или конструкция. Наиболее эффективны следующие методы:
- Нанесение поверхностных атмосферостойких покрытий;
- Поверхностная металлизация;
- Легирование металла элементами, обладающими большей стойкостью к участию в окислительно-восстановительных реакциях;
- Изменение химического состава окружающей среды.
Механические поверхностные покрытия
Поверхностная защита металла может быть выполнена его окрашиванием либо нанесением поверхностных плёнок, по своему составу нейтральных к воздействию кислорода. В быту, а также при обработке сравнительно больших площадей (главным образом, подземных трубопроводов) применяется окраска. Среди наиболее стойких красок – эмали и краски, содержащие алюминий. В первом случае эффект достигается перекрытием доступа кислороду к стальной поверхности, а во втором – нанесением алюминия на поверхность, который, являясь химически инертным металлом, предохраняет сталь от коррозионного разрушения.
Положительными особенностями данного способа защиты являются лёгкость его реализации и сравнительно небольшие финансовые затраты, поскольку процесс достаточно просто механизируется. Вместе с тем долговечность такого способа защиты невелика, поскольку, не обладая большой степенью сродства с основным металлом, такие покрытия через некоторое время начинают механически разрушаться.

Химические поверхностные покрытия
Коррозионная защита в данном случае происходит вследствие образования на поверхности обрабатываемого металла химической плёнки, состоящей из компонентов, стойких к воздействию кислорода, давлений, температур и влажности. Например, углеродистые стали обрабатывают фосфатированием. Процесс может выполняться как в холодном, так и в горячем состоянии, и заключается в формировании на поверхности металла слоя из фосфатных солей марганца и цинка. Аналогом фосфатированию выступает оксалатирование – процесс обработки металла солями щавелевой кислоты. Применением именно таких технологий повышают стойкость металлов от трибохимической коррозии.
Недостатком данных методов является трудоёмкость и сложность их применения, требующая наличия специального оборудования. Кроме того, конечная поверхность изменяет свой цвет, что не всегда приемлемо по эстетическим соображениям.
Легирование и металлизация
В отличие от предыдущих способов, здесь конечным результатом является образование слоя металла, химически инертного к воздействию кислорода. К числу таких металлов относятся те, которые на линии кислородной активности находятся возможно дальше от водорода. По мере возрастания эффективности этот ряд выглядит так: хром→медь→цинк→серебро→алюминий→платина. Различие в технологиях получения таких антикоррозионных слоёв состоит в способе их нанесения. При металлизации на поверхность направляется ионизированный дуговой поток мелкодисперсного напыляемого металла, а легирование реализуется в процессе выплавки металла, как следствие протекания металлургических реакций между основным металлом и вводимыми легирующими добавками.

Изменение состава окружающей среды
В некоторых случаях существенного снижения коррозии удаётся добиться изменением состава атмосферы, в которой работает защищаемая металлоконструкция. Это может быть вакуумирование (для сравнительно небольших объектов), или работа в среде инертных газов (аргон, неон, ксенон). Данный метод весьма эффективен, однако требует дополнительного оборудования – защитных камер, костюмов для обслуживающего персонала и т.д. Используется он главным образом, в научно-исследовательских лабораториях и опытных производствах, где специально поддерживается необходимый микроклимат.
Кто нам мешает, тот нам поможет
В завершение укажем и на довольно необычный способ коррозионной защиты: с помощью самих окислов железа, точнее, одного из них – закиси-окиси Fe3O4. Данное вещество образуется при температурах 250…5000С и по своим механическим свойствам представляет собой высоковязкую технологическую смазку. Присутствуя на поверхности заготовки, Fe3O4 перекрывает доступ кислороду воздуха при полугорячей деформации металлов и сплавов, и тем самым блокирует процесс зарождения трибохимической коррозии. Это явление используется при скоростной высадке труднодеформируемых металлов и сплавов. Эффективность данного способа обусловлена тем, что при каждом технологическом цикле контактные поверхности обновляются, а потому стабильность процесса регулируется автоматически.
Способы защиты металлов от коррозии, виды коррозии металла
Коррозия металла представляет собой его разрушение, как результат окисления под действием химических или электрохимических процессов. Яркими примером такой коррозии является ржавление. Однако разновидностей коррозии металлов немало.
Виды коррозии металла
Существует несколько классификаций коррозии металлов. Так, по виду разрушений выделяют сплошную, местную и точечную коррозии. Первая поражает всю поверхность металла равномерно. При местной коррозии выделяются отдельные коррозионные пятна. А точечная коррозия указывает на начальную стадию поражения и проявляется в отдельных точках разрушений.
По характеру проникновения внутрь металла можно выделить межкристаллитную (интеркристаллитную) и транскристаллитную коррозии. Первая проникает между зернами металла, выбирая наиболее слабые места их соединений. Вторая проходит прямо через зерна металла. Обе опасны тем, что быстро приводят к растрескиванию металла и потере им прочности. При этом поверхность изделия может оставаться нетронутой.
Отдельно в данной классификации можно выделить ножевую коррозию, которая обычно приводит к ровной трещине, располагающейся параллельно сварочному шву. Как правило, она возникает при использовании металлических изделий в агрессивных средах.
По способу взаимодействия металла со средой принято выделять химическую и электрохимическую коррозию. металла. При химической атомы металла связываются с атомами действующих на него окислителей, входящих в состав среды. Как правило, это происходит при взаимодействии со средой, не являющейся проводником электричества. При электрохимической коррозии катионы кристаллической решетки металла связываются с другими составляющими коррозионной среды. При этом сам окислитель заполучает высвободившиеся электроны. Подобный тип коррозии характерен для взаимодействия металлов с растворами или расплавами электролитов.
Можно выделить виды коррозии металла по типу среды, воздействующей на него. Так, выделяют газовую, атмосферную, жидкостную и подземную коррозии. Однако чаще всего речь идет о смешанных типах коррозии, когда на металл воздействует сразу несколько сред.
Методы защиты металлов от коррозии
Существует несколько основных методов защиты металла от коррозии:
– увеличение химического состава металла с целью повышения его антикоррозийных характеристик;
– изоляция поверхности металла антикоррозийными материалами;
– снижение агрессивности среды, в которой производятся и эксплуатируются металлические изделия;
– наложение внешнего тока, обеспечивающего электрохимическую защиту от коррозии.
Таким образом, можно защитить металлические изделия от коррозии до начала их эксплуатации или во время нее.
Мы давно занимаемся проблемой защиты металла от коррозии и можем предложить наилучшие варианты. Самый простой из них и широко применяемый нами – это использование специальных металлических защитных покрытий. Так, применение анодных покрытий увеличивает до максимума отрицательных электрохимический потенциал металла, исключая возможность его коррозии. Катодное покрытие имеет менее выраженное действие и требует нанесения более толстого слоя, но при этом оно значительно увеличивает твердость и износостойкость изделия.
Если рассматривать виды покрытия с точки зрения их получения, то можно выделить химическое и электролитическое осаждения, горячее и холодное нанесения, металлическое напыление, плакирование и термодиффузионную обработку.
Одним из самых популярных способов защиты металла от коррозии является нанесение неметаллических составов. Это может быть пластик, керамика, каучук, битум, полиуретан, лакокрасочные составы и многое другое. Причем последние представляют собой наиболее широкий ассортимент и могут применяться в зависимости от условий среды, в которых будет использоваться изделие. Так выделяют лакокрасочные покрытия, устойчивые к действиям воды, атмосферы, химическим растворам и т. д.
Для смягчения действия коррозионной среды можно ввести в нее небольшое количество ингибиторов, которые приводят к нейтрализации или обескислороживанию среды и образуют адсорбционную пленку, защищающую поверхность металла. При этом пленка может в некоторой степени изменить электрохимические показатели металлов.
Электрохимическая коррозионная защита металлов заключается в катодной или анодной поляризации (внешнем воздействии тока). Это также возможно осуществить путем присоединения к металлическому изделию протекторов, замедляющих коррозию.
В современном производстве большое значение уделяется разработке устойчивых к коррозии металлических сплавов. Например, коррозионная устойчивость значительно повышается при добавлении в железный сплав хрома и никеля. Магниевые сплавы с этой же целью легируются марганцем, а никелевые – медью.
Проблеме защиты металлической продукции от коррозии наша компания «Черметком» уделяет большое внимание, нанося специальные покрытия, производя обработку изделий из металла электрическим током или выполняя протекторную защиту. У нас вы также можете приобрести изделия, созданные из устойчивых к коррозии сплавов. Причем металл и продукцию из него можно купить на наших складах в Москве или заказать их изготовление по индивидуальному проекту.
Дополнительная вкладка, для размещения информации о магазине, доставке или любого другого важного контента. Поможет вам ответить на интересующие покупателя вопросы и развеять его сомнения в покупке. Используйте её по своему усмотрению.
Вы можете убрать её или вернуть обратно, изменив одну галочку в настройках компонента. Очень удобно.



