Медь это щелочной металл
Медь — свойства, характеристики свойства
 Медь – это пластичный золотисто-розовый металл с характерным металлическим блеском. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Сu (Cuprum) и находится под порядковым номером 29 в I группе (побочной подгруппе), в 4 периоде.
Медь – это пластичный золотисто-розовый металл с характерным металлическим блеском. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Сu (Cuprum) и находится под порядковым номером 29 в I группе (побочной подгруппе), в 4 периоде.
Латинское название Cuprum произошло от имени острова Кипр. Известны факты, что на Кипре ещё в III веке до нашей эры находились медные рудники и местные умельцы выплавляли медь. Купить медь можно в комании «КУПРУМ».
По данным историков, знакомству общества с медью около девяти тысячелетий. Самые древние медные изделия найдены во время археологических раскопок на местности современной Турции. Археологи обнаружили маленькие медные бусинки и пластинки для украшения одежды. Находки датируются рубежом VIII-VII тыс. до нашей эры. Из меди в древности изготавливали украшения, дорогую посуду и различные инструменты с тонким лезвием.
Великим достижением древних металлургов можно назвать получение сплава с медной основой – бронзы.
Основные свойства меди
1. Физические свойства.
На воздухе медь приобретает яркий желтовато-красный оттенок за счёт образования оксидной плёнки. Тонкие же пластинки при просвечивании зеленовато-голубого цвета. В чистом виде медь достаточно мягкая, тягучая и легко прокатывается и вытягивается. Примеси способны повысить её твёрдость.
Высокую электропроводность меди можно назвать главным свойством, определяющим её преимущественное использование. Также медь обладает очень высокой теплопроводностью. Такие примеси как железо, фосфор, олово, сурьма и мышьяк влияют на базовые свойства и уменьшают электропроводность и теплопроводность. По данным показателям медь уступает лишь серебру.
Медь обладает высокими значениями плотности, температуры плавления и температуры кипения. Важным свойством также является хорошая стойкость по отношению к коррозии. К примеру, при высокой влажности железо окисляется значительно быстрее.
Медь хорошо поддаётся обработке: прокатывается в медный лист и медный пруток, протягивается в медную проволоку с толщиной, доведённой до тысячных долей миллиметра. Этот металл является диамагнетиком, то есть намагничивается против направления внешнего магнитного поля.

2. Химические свойства.
Медь является сравнительно малоактивным металлом. В нормальных условиях на сухом воздухе её окисления не происходит. Она легко реагирует с галогенами, селеном и серой. Кислоты без окислительных свойств не оказывают воздействия на медь. С водородом, углеродом и азотом химических реакций нет. На влажном воздухе происходит окисление с образованием карбоната меди (II) – верхнего слоя платины.
Медь обладает амфотерностью, то есть в земной коре образует катионы и анионы. В зависимости от условий, соединения меди проявляют кислотные или основные свойства.

Способы получения меди
В природе медь существует в соединениях и в виде самородков. Соединения представлены оксидами, гидрокарбонатами, сернистыми и углекислыми комплексами, а также сульфидными рудами. Самые распространённые руды – это медный колчедан и медный блеск. Содержание меди в них составляет 1-2%. 90% первичной меди добывают пирометаллургическим способом и 10% гидрометаллургическим.
1. Пирометаллургический способ включает в себя такие процессы: обогащение и обжиг, плавка на штейн, продувка в конвертере, электролитическое рафинирование.
Обогащают медные руды методом флотации и окислительного обжига. Сущность метода флотации заключается в следующем: частицы меди, взвешенные в водной среде, прилипают к поверхности пузырьков воздуха и поднимаются на поверхность. Метод позволяет получить медный порошкообразный концентрат, который содержит 10-35% меди.
Окислительному обжигу подлежат медные руды и концентраты со значительным содержанием серы. При нагреве в присутствии кислорода происходит окисление сульфидов, и количество серы снижается почти в два раза. Обжигу подвергаются бедные концентраты, в которых содержится 8-25% меди. Богатые концентраты, содержащие 25-35% меди, плавят, не прибегая к обжигу.
Следующий этап пирометаллургического способа получения меди – это плавка на штейн. Если в качестве сырья используется кусковая медная руда с большим количеством серы, то плавку проводят в шахтных печах. А для порошкообразного флотационного концентрата применяют отражательные печи. Плавка происходит при температуре 1450 °С.
В горизонтальных конвертерах с боковым дутьём медный штейн продувается сжатым воздухом для того, чтобы произошли процессы окисления сульфидов и феррума. Далее образовавшиеся окислы переводят в шлак, а серу в оксид. В конвертере образуется черновая медь, которая содержит 98,4-99,4% меди, железо, серу, а также незначительное количество никеля, олова, серебра и золота.
Черновая медь подлежит огневому, а далее электролитическому рафинированию. Примеси удаляют с газами и переводят в шлак. В результате огневого рафинирования образуется медь с чистотой до 99,5%. А после электролитического рафинирования чистота составляет 99,95%.
2. Гидрометаллургический способ заключается в выщелачивании меди слабым раствором серной кислоты, а затем выделении металлической меди непосредственно из раствора. Такой способ применяется для переработки бедных руд и не допускает попутного извлечения драгоценных металлов вместе с медью.

Применение меди
Благодаря ценным качествам медь и медные сплавы используются в электротехнической и электромашиностроительной отрасли, в радиоэлектронике и приборостроении. Существуют сплавы меди с такими металлами, как цинк, олово, алюминий, никель, титан, серебро, золото. Реже применяются сплавы с неметаллами: фосфором, серой, кислородом. Выделяют две группы медных сплавов: латуни (сплавы с цинком) и бронзы (сплавы с другими элементами).
Медь обладает высокой экологичностью, что допускает её использование в строительстве жилых домов. К примеру, медная кровля за счёт антикоррозионных свойств, может прослужить больше ста лет без специального ухода и покраски.
Медь в сплавах с золотом используется в ювелирном деле. Такой сплав увеличивает прочность изделия, повышает стойкость к деформированию и истиранию.
Для соединений меди характерна высокая биологическая активность. В растениях медь принимает участие в синтезе хлорофилла. Поэтому её можно увидеть в составе минеральных удобрений. Недостаток меди в организме человека может вызвать ухудшение состава крови. Она есть в составе многих продуктов питания. К примеру, этот металл содержится в молоке. Однако важно помнить, что избыток соединений меди может вызвать отравление. Именно поэтому нельзя готовить пищу в медной посуде. Во время кипячения в пищу может попасть большое количество меди. Если же посуда внутри покрыта слоем олова, то опасности отравления нет.
В медицине медь используют, как антисептическое и вяжущее средство. Она является компонентом глазных капель от конъюнктивита и растворов от ожогов.
Медь это щелочной металл

Самородная медь размером около 4 см
Медь — минерал из класса самородных элементов. В природном минерале обнаруживаются Fe, Ag, Au, As и другие элементы в виде примеси или образующие с Cu твёрдые растворы. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. Он входит в семёрку металлов, известных человеку с очень древних времён. Медь является необходимым элементом для всех высших растений и животных.
Смотрите так же:
СТРУКТУРА
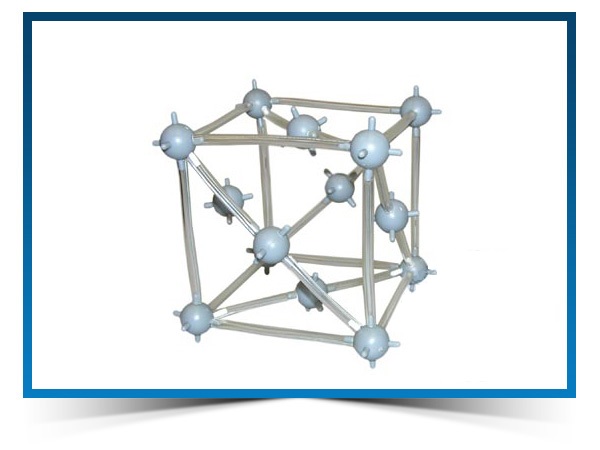
Кристаллическая структура меди
Кубическая сингония, гексаоктаэдрический вид симметрии m3m, кристаллическая структура — кубическая гранецентрированная решётка. Модель представляет собой куб из восьми атомов в углах и шести атомов , расположенных в центре граней (6 граней). Каждый атом данной кристаллической решетки имеет координационное число 12. Самородная медь встречается в виде пластинок, губчатых и сплошных масс, нитевидных и проволочных агрегатов, а также кристаллов, сложных двойников, скелетных кристаллов и дендритов. Поверхность часто покрыта плёнками «медной зелени» (малахит), «медной сини» (азурит), фосфатов меди и других продуктов её вторичного изменения.
СВОЙСТВА
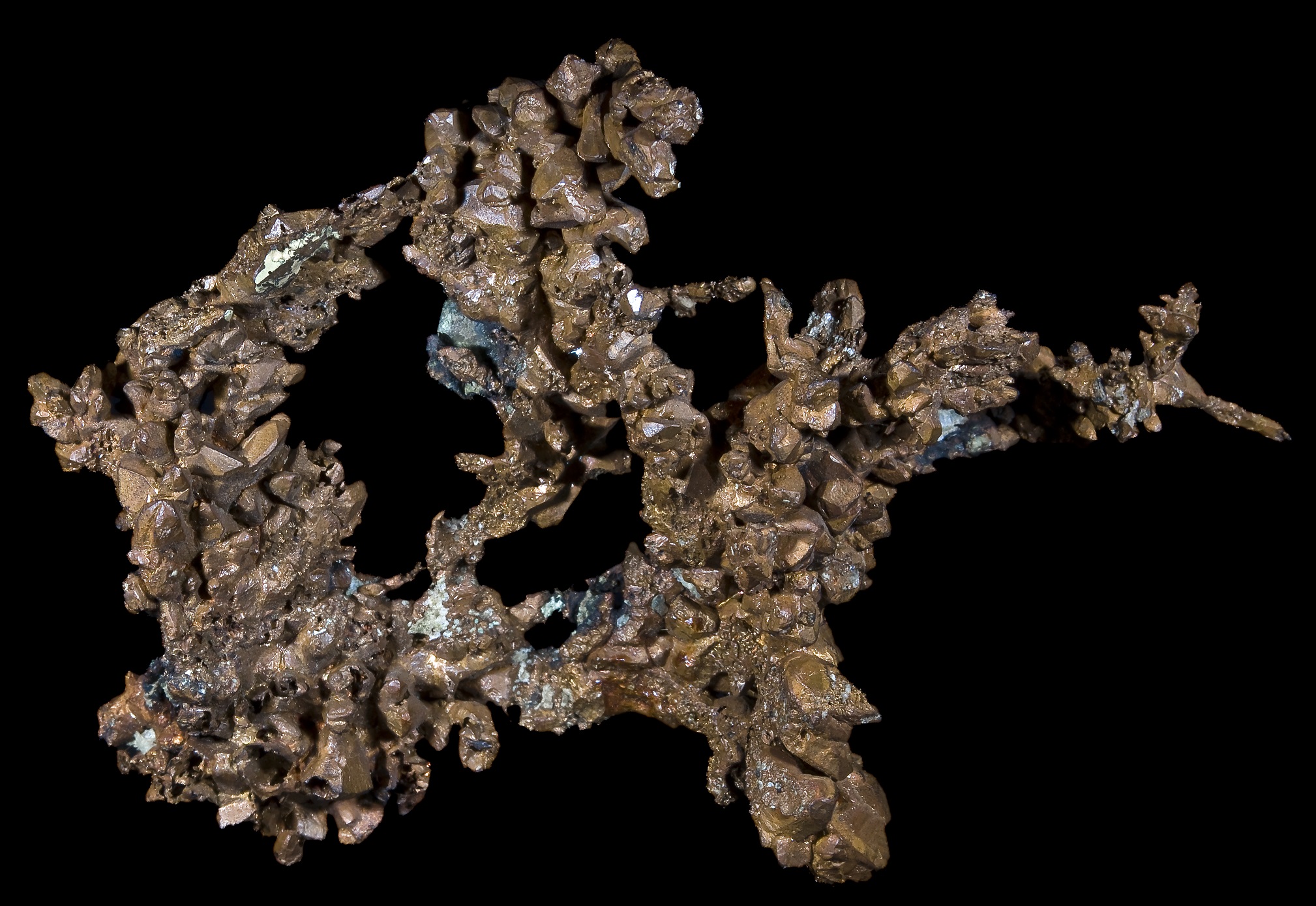
Кристаллы самородной меди, Верхнее озеро, округ Кинави, Мичиган, США. Размер 12 х 8,5 см
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5-58 МСм/м. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
ЗАПАСЫ И ДОБЫЧА

Образец меди, 13,6 см. Полуостров Кинави, Мичиган, США
Среднее содержание меди в земной коре (кларк) — (4,7-5,5)·10 −3 % (по массе). В морской и речной воде содержание меди гораздо меньше: 3·10 −7 % и 10 −7 % (по массе) соответственно. Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз. Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом.
ПРОИСХОЖДЕНИЕ

Небольшой самородок меди
Обычно самородная медь образуется в зоне окисления некоторых медносульфидных месторождений в ассоциации с кальцитом, самородным серебром, купритом, малахитом, азуритом, брошантитом и другими минералами. Массы отдельных скоплений самородной меди достигают 400 тонн. Крупные промышленные месторождения самородной меди вместе с другими медьсодержащими минералами формируются при воздействии на вулканические породы (диабазы, мелафиры) гидротермальных растворов, вулканических паров и газов, обогащенных летучими соединениями меди (например, месторождение озера Верхнее, США).
Самородная медь встречается также в осадочных породах, преимущественно в медистых песчаниках и сланцах.
Наиболее известные месторождения самородной меди — Туринские рудники (Урал), Джезказганское (Казахстан), в США (на полуострове Кивино, в штатах Аризона и Юта).
ПРИМЕНЕНИЕ

Браслеты из меди
Из-за низкого удельного сопротивления, медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов и силовых трансформаторов.
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые помимо олова и цинка могут входить никель, висмут и другие металлы.
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Химические свойства элементов: медь
Ключевые слова: медь, нахождение меди в природе, получение меди, физические свойства меди, сплавы. меди, химические свойства меди.
Медь (Cuprum), Си — химический элемент побочной подгруппы первой группы периодической системы элементов Д.И. Менделеева. Латинское название происходит от острова Кипр, где древние греки добывали медную руду. Порядковый номер 29, атомная масса меди 63,54. Природная медь состоит из смеси 2-х стабильных изотопов 63 Cu (69,1%) и 65 Cu (30,9%). Путем бомбардировки никеля протонами или ядрами дейтерия искусственно получают радиоактивные изотопы меди 6l Cu и 64 Си с периодами полураспада 3,3 и 12,8 часов соответственно. Эти изотопы обладают высокой удельной активностью и используются в качестве меченых атомов. В химическом отношении медь занимает промежуточное положение между элементами главной подгруппы VIII группы и щелочными элементами I группы периодической системы.
НАХОЖДЕНИЕ МЕДИ В ПРИРОДЕ
Содержание меди в земной коре составляет около 0,01%. Она встречается в свободном состоянии в виде самородков, достигающих значительных размеров (до нескольких тонн). Однако руды самородной меди сравнительно мало распространены, и в настоящее время из них добывается не более 5% меди от общей ее мировой добычи. Медь является халькофильным элементом. До 80% ее присутствует в земной коре в виде соединений с серой. Около 15% меди находится в виде карбонатов, силикатов, оксидов, являющихся продуктами выветривания первичных сульфидных медных руд.Медь образует до 240 минералов, однако лишь около 40 имеют промышленное значение .Различают сульфидные и окисленные руды меди. Промышленное значение имеют сульфидные руды, из которых наиболее широко используется медный колчедан (халькопирит) CuFeS2. В природе он встречается главным образом в смеси с железным колчеданом FeS2 и пустой породой, состоящей из оксидов кремния, алюминия, кальция . Часто сульфидные руды содержат примеси благородных металлов (золота, серебра), цветных и редких металлов ( цинка, свинца, никеля, кобальта, молибдена ) и рассеянных элементов (германий).Содержание меди в руде обычно составляет 1—5%, но благодаря технологии флотации, ее можно обогащать, получая концентрат, содержащий 20% меди и более . Наиболее крупные запасы медных руд в России сосредоточены главным образом на Урале, в Казахстане и Средней Азии, за рубежом — в Африке (Катанта, Замбия), Америке (Чили, США, Канада).
ПОЛУЧЕНИЕ МЕДИ
Руды и получаемые из них путем механического обогащения концентраты перерабатывают на медь пирометаллургическим и гидрометаллургическим методами . Первый из них применяется преимущественно для переработки сернистых руд. Вторым методом, получившим небольшое распространение, перерабатывают окисленные и смешанные бедные руды, содержащие около 1% меди.Пирометаллургический метод заключается в обжиге концентратов, плавке полученного огарка на штейн (сплав сульфидов меди и железа), продувке штейна в конвертере с получением черновой меди (содержащей около 5% примесей), рафинировании последних огневым процессом или электролизом для получения чистой меди. Гидрометаллургический метод получения меди заключается в извлечении ее из руд различными растворителями с последующим выделением металла из растворов электролизом или посредством вытеснения его железом в виде цементной меди. Иногда медь выделяют в виде оксида.
ФИЗИЧЕСКИЕ СВОЙСТВА МЕДИ
Техническая медь — металл красного, в изломе розового цвета, при просвечивании в тонких слоях — зеленовато-голубой. Имеет гранецентрированную кубическую решетку, плотность 8,96 кг/м3 (20°С). Медь — вязкий, мягкий и ковкий металл, уступающий только серебру высокими теплопроводностью и электропроводностью. Эти качества, а также пластичность и сопротивление коррозии обусловили широкое применение меди в промышленности.
СПЛАВЫ МЕДИ
Небольшие примеси висмута (0,001%*) и свинца (0,01%) делают медь ломкой, а примесь серы вызывает хрупкость на холоду .С металлами медь образует различные сплавы. В двухкомпонентных медных сплавах с Zn, Sn, Al, Ni, Fe, Mn, Si, Be, Cr, Pb, P и др. легирующий элемент входит в твердый раствор замещения на основе Си, а также может образовывать электронные соединения, характеризующиеся определенной электронной концентрацией. В многокомпонентных сплавах часто присутствуют сложные металлические соединения точно неустановленного состава. Легирующие элементы вводят в медь для повышения прочности и твердости, улучшения антифрикционных свойств и стойкости против коррозии и для получения сплавов с заданными физическими свойствами. Медные сплавы делят на латуни, бронзы и медно-никелевые сплавы .
Латунями называют сплавы меди и цинка. Медь может растворять цинк в любом количестве. При добавлении к меди до 45—47% Zn увеличивается предел прочности сплава при растяжении; дальнейшее увеличение содержания цинка вызывает снижение предела прочности. Вязкость (пластичность) сплава возрастает при добавлении к меди до 30—32% Zn, а затем уменьшается, достигая очень малой величины при содержании 47—50% Zn.
Ковкая латунь (мунц-металл) содержит 60% Си и 40% Zn, томпак — 90—80% Си и 10—20% Zn. Состав специальных латуней: алюминиевая (66—68% Си,
30% Zn), марганцовисто-свинцовая (57—60% Си, 1,5—2,5% РЬ; 1,5—2,5% Мп, -38% Zn).
Бронзами называют сплавы меди с оловом. В присутствии олова улучшаются механические свойства меди, бронзы обладают хорошими литейными свойствами. Обычно содержание олова не превышает 10%. Алюминиевая бронза содержит 82—90% Си, 4—10% Al, 1—6% Fe + Si; кремнеоловянная бронза — 99,94% Си, по 0,03% Sn и Si.
Сплавы меди с никелем. Никель сильно повышает твердость меди. Сплав 50% Си и 50% Ni обладает наибольшей твердостью. Кроме высокой твердости, эти сплавы обладают пониженной электропроводностью, вследствие чего употребляются в электротехнике .
Хорошие механические свойства, высокая стойкость против коррозии во многих средах, ценные физические свойства в сочетании с простотой плавки, литья и обработки давлением обусловили широкое применение медных сплавов в многочисленных отраслях техники: в авиа-, авто-, судостроении, химической промышленности, станкостроении, электротехнике, приборостроении, в производстве паровой и водяной арматуры, посуды, художественных и других изделий.
ХИМИЧЕСКИЕ СВОЙСТВА МЕДИ
Медь — электроположительный металл. Медь вытесняется из своих солей более электроотрицательными элементами и не растворяется в кислотах, не являющихся окислителями. Медь растворяется в азотной кислоте с образованием (Си(NOз)2 и оксидов азота, в горячей конц. H2SO4 — с образованием CuSO4 и SO2. В нагретой разбавленной H2SO4 медь растворяется только при продувании через раствор воздуха.Химическая активность меди невелика, при температурах ниже 185°С с сухим воздухом и кислородом не реагирует. В присутствии влаги и СО2 на поверхности меди образуется зеленая пленка основного карбоната. При нагревании меди на воздухе идет поверхностное окисление; ниже 375°С образуется СиО, а в интервале 375—1100°С при неполном окислении меди — двухслойная окалина (СиО + СuО). Влажный хлор взаимодействует с медью уже при комнатной температуре, образуя хлорид меди(II), хорошо растворимый в воде. Медь реагирует и с другими галогенами. Особое сродство проявляет медь к сере: в парах серы она горит. С водородом, азотом, углеродом медь не реагирует даже при высоких температурах. Растворимость водорода в твердой меди незначительна и при 400°С составляет 0,06 г в 100 г меди. Присутствие водорода в меди резко ухудшает ее механические свойства (так называемая «водородная болезнь»). При пропускании аммиака над раскаленной медью образуется Cu2N. Уже при температуре каления медь подвергается воздействию оксидов азота: N2O и NO взаимодействуют с образованием СuО, a NO2 — с образованием СиО. Карбиды Cu2C2 и СuС2 могут быть получены действием ацетилена на аммиачные растворы солей меди. Оксид меди(I) Си2O красного цвета, незначительно растворяется в воде. При взаимодействии сильных щелочей с солями меди(I) выпадает желтый осадок, переходящий при нагревании в осадок красного цвета, по-видимому Сu2О. Гидроксид меди(I) обладает слабыми основными свойствами, он немного растворим в концентрированных растворах щелочей.
Подгруппа меди
Особенности атомных структур элементов побочных подгрупп
В данной главе мы будем рассматривать элементы побочных подгрупп I—VIII группы. Все они являются элементами больших периодов.
Элементы этих подгрупп имеют свои особенности в строении атомов. У элементов главных подгрупп происходит постепенное завершение внешнего электронного слоя, который содержит только s— и р-оболочки. У элементов же побочных подгрупп предвнешний слой находится в процессе завершения, а внешний слой при этом, как правило, сохраняет неизменно 2 электрона. На предвнешнем слое возникает и заполняется d-оболочка, состоящая из 5 d-орбиталей. На каждой орбитали 2 электрона, поэтому заполнение d-орбиталей происходит последовательно у 10 элементов, расположенных по возрастанию порядковых номеров. Элементы побочных подгрупп всех групп, за исключением I и II, принадлежат к числу d-элементов.
Валентными у элементов побочных подгрупп являются электроны, расположенные как во внешнем слое на s-орбиталях, так и на d-орбиталях более глубокого предвнешнего слоя. Таким образом, для этих элементов характерно образование различного числа валентных связей. Легче всего, разумеется, участвуют в образовании химической связи электроны внешнего слоя; их в атоме один или два. Такое строение атома типично для металла, поэтому элементы побочных подгрупп обладают обычно металлическими свойствами.
■ 1 . Начертите схемы строения атомов скандия, титана, ниобия. (См. Ответ)
Укажите электронные конфигурации внешнего и предвнешнего электронных слоев их атомов. Изобразите размещение электронов внешнего и предвнешнего слоев по орбиталям.
2. В чем отличие структуры внешнего электронного слоя атомов элементов главных подгрупп от атомов элементов побочных подгрупп.
3. Какими свойствами должны обладать элементы побочных подгрупп в связи с строением их атомов.
4. Сколько электронов вмещает d-оболочка электронного слоя? (См. Ответ)
Подгруппа меди
Начнем рассмотрение элементов побочных подгрупп с подгруппы меди. К элементам подгруппы меди относятся медь Сu, серебро Ag и золото Аu, расположенные в побочной подгруппе I группы. Распределение электронов по энергетическим уровням у этих элементов приведено в табл. 22.
Радиусы атомов элементов побочной подгруппы значительно меньше радиусов атомов элементов главной подгруппы, поэтому электрон внешнего электронного слоя с большим трудом отрывается от атома. Как видно из табл. 22, эти элементы имеют сходное строение не только внешнего, но и предвнешнего слоя, и мы вправе ожидать от них большого сходства химических свойств.
В табл. 23 приведены физические свойства металлов подгруппы меди.
■ 5. Сравните радиусы атомов щелочных металлов и металлов подгруппы меди тех же периодов. Какой вывод можно сделать?
6. Почему у элементов подгруппы меди электрон внешнего слоя удерживается прочнее, чем в атомах щелочных металлов?
7. К какой группе металлов по плотности следует отнести металлы подгруппы меди? (См. Ответ)
Медь Сu
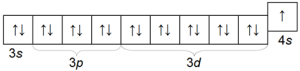
Химический знак Сu, атомный вес 63,54. Медь — типичный металл, поэтому ее атомы связаны между собой металлической связью. Электронная конфигурация предвнешнего и внешнего электронных слоев меди выглядит следующим образом: 3s 2 3p 6 3d 10 4s 1 .
По внешнему виду медь — вещество красного цвета с характерным металлическим блеском. Медь — довольно мягкий металл, однако намного тверже, чем щелочные.
Следует отметить высокую пластичность меди, которую она проявляет не только в нагретом, но и в холодном состоянии. Благодаря своей мягкости и пластичности медь может быть подвергнута холодной обработке. Отсюда широкое использование этого металла для изготовления художественных изделий при помощи чеканки. Не только сама медь, но и все металлы этой подгруппы обладают высокой пластичностью.
Медь что это такое
Один из лучших проводников тепла и электричества, однако для использования ее в этих целях медь обычно хорошо очищают от примесей других металлов, так как даже от незначительных загрязнений ее электропроводность сильно уменьшается.
Химические свойства меди и ее аналогов очень отличаются от свойств щелочных металлов, расположенных в главной подгруппе I группы. Так, они располагаются в ряду напряжений после водорода. Степень окисления меди в окислительно-восстановительных реакциях +1 или +2. Других степеней окисления медь обычно не проявляет.
Медь довольно легко сплавляется с другими металлами, образуя ряд сплавов, наиболее распространенными из которых являются бронза (сплав, состоящий из меди и олова) и латунь (сплав меди и цинка).
При обычной температуре медь постепенно вступает во взаимодействие с кислородом, двуокисью углерода и влагой воздуха, превращаясь в основной карбонат меди. Этот процесс протекает очень медленно и объясняет причину, по которой изделия из меди с течением времени покрываются зеленым налетом.
При прокаливании на газовой горелке медь покрывается черным налетом окиси меди СuО. Нагретая медь довольно легко вступает во взаимодействие с хлором, образуя хлорид меди (II), и с некоторыми другими неметаллами.
С разбавленными кислотами медь обычно в реакции не вступает, так как не может вытеснить водород, но с разбавленной азотной кислотой реагирует без вытеснения водорода, однако с выделением окиси азота. С концентрированными серной и азотной кислотой медь также вступает в окислительно-восстановительную реакцию, которая также протекает без вытеснения водорода. Во всех названных реакциях медь в основном проявляет свою высшую валентность II. Соединения одновалентной меди получить значительно сложнее.
■ 8. Какова электронная конфигурация внешнего и предвнешнего слоя атома меди? (См. Ответ)
9. Перечислите физические свойства меди и укажите, где они находят себе применение.
10. Напишите следующие уравнения реакций, характеризующих химические свойства меди: а) взаимодействие с кислородом; б) взаимодействие с хлором; в) взаимодействие с водой, кислородом и двуокисью углерода воздуха; г) с концентрированными серной и азотной кислотами; д) с разбавленной азотной кислотой.
Все уравнения рассмотрите с точки зрения окислительно-восстановительных процессов. Если реакция ионная, запишите уравнение в полной и сокращенной ионной форме.
11. Для получения медного купороса CuSO4-5H2O медный лом прокаливают на воздухе и получившийся продукт обрабатывают 70% серной кислотой. Сколько меди и раствора серной кислоты израсходуется на получение 125 т медного купороса? Напишите уравнения протекающих при этом реакций.
12 Приведите все известные вам способы получения хлорида меди (II), сульфата меди (II), нитрата меди (II), исходя из чистой меди. Уравнения реакций записывайте в ионной форме, а в окислительно-восстановительных указывайте окислитель и восстановитель. Для реакций можно использовать дополнительно любые вещества. Процессы можно вести с любым количеством промежуточных веществ.
13. Почему металлическую медь можно получить электролизом раствора хлорида, а металлический натрий — нельзя. (См. Ответ)
Соединения меди
Медь образует два ряда соединений—соединения двухвалентной и одновалентной меди.
Соединения двухвалентной меди — это СuО (окись меди), гидроокись меди и наиболее распространенные соли.
Окись меди представляет собой твердое вещество черного цвета, поступает в лаборатории в виде порошка или гранул (гранулированная окись меди). Ее получают обычно из металлической меди путем прокаливания на воздухе, а также разложением солей, например:
Cu2(OH)2CO3 = 2CuO + Н2O + CO2
Окись меди — основной окисел, при обычных условиях весьма устойчивый. При небольшом нагревании окись меди довольно легко восстанавливается водородом или углеродом до металлической меди:
СuО + С = Сu + СО СuО + Н2 = Сu + Н2O
С водой окись меди никогда не реагирует, поэтому соответствующее ей основание — гидроокись меди Си(ОН)4— никогда не образуется путем взаимодействия окисла с водой. Гидроокись меди — слабое нерастворимое основание, легко вступает во взаимодействие с кислотами с образованием солей:
Сu(ОН)2 + H2SO4 = CuSO4 + 2Н2O
Cu(OH)2 + 2Н + + SO 2- = Cu 2+ + SO 2 4 — + 2H2O
Cu(OH)2 + 2H + = Cu 2+ + 2H2O
Взаимодействие со щелочами при некоторых условиях возможно, но совершенно нетипично, хотя и свидетельствует об очень слабо выраженных амфотерных свойствах. Гидроокись меди легко растворяется в аммиаке, образуя раствор ярко-синего цвета. Этот раствор нередко применяется в органической химии для разного рода качественных реакций, а также иногда для обработки целлюлозы.
Гидроокись меди легко разлагается даже при простом хранении на воздухе:
Cu(OH)2 = СuО + Н20
При этом она чернеет, превращаясь постепенно в черную окись меди.
Из солей меди наиболее распространены медный купорос CuSO4 · 5H2O, хлорид меди СuСl2 · 2Н2O, нитрат меди Cu(NO3)2 · 3H2O, сульфид меди CuS. Кристаллогидраты медных солей при нагревании довольно легко отдают кристаллизационную воду, теряя свою окраску. Обычно кристаллические медные соли и их растворы имеют красивую голубую окраску. Медные соли используют для борьбы с сельскохозяйственными вредителями, в текстильной промышленности для изготовления красителей.
В природе медь встречается в виде минерала — самородной меди, однако чаще ее добывают в виде сульфидов (важнейшие—халькозин Cu2S, халькопирит CuFeS2 ит.д). Полученную из них медь очищают электролизом (рафинируют), а затем используют для изготовления проводов медных сплавов и других изделий.
■ 14. Как осуществить ряд превращений: (См. Ответ)
Сu → Cu(NO3)2 → CuO → Cu(OH)2 → CuSO4 → CuCl2.?
15. Окись меди прокалили в токе водорода, затем обработали концентрированной азотной кислотой до прекращения выделения бурого газа, далее, добавив щелочи, получили студенистый голубой осадок. Какие химические процессы происходили? Напишите их уравнения в молекулярной и ионных формах.
16. Даны окись меди, вода, серная кислота, нитрат серебра. Как, не имея других веществ, получить медь, нитрат меди, сульфат меди.
17. Смесь карбоната и нитрата меди подвергли прокаливанию. Что останется в реакционном сосуде после прокаливания? Каков состав выходящей смеси газов?
18. Смесь меди с окисью меди обработали 30% азотной кислотой. При этом выделилось 2,8 л окиси азота. Известно, что в составе смеси медь составляет 40% Какой объем раствора азотной кислоты был израсходован на реакцию? (См. Ответ)
Серебро и золото
Серебро Ag и золото Аu — аналоги меди, но относятся к числу так называемых благородных металлов. Такое название возникло из-за того, что эти металлы обладают значительной химической стойкостью к окислению.
Электронные конфигурации внешних и предвиешних слоев атомов серебра и золота:
Ag 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 1
Au 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 6s 1 .
Серебро и золото — наиболее ковкие металлы, причем на первом месте по мягкости и ковкости стоит золото, а серебро — на втором. Однако по электро- и теплопроводности на первом месте находится серебро. Цвет у этих металлов различный. Серебро белого цвета, а золото — желтого.
Как уже было сказано, серебро и золото устойчивы к окислению и длительное время могут сохраняться, не изменяя внешнего вида. В связи с этим, а также благодаря мягкости они легко шлифуются, полируются и потому используются для разного рода поделок и украшений. Золото применяют в стоматологии для изготовления зубных коронок. Серебро также используют в медицине для изготовления некоторых инструментов. Гораздо чаще, чем чистые металлы, применяют их сплавы с медью, обладающие антикоррозийной стойкостью, но благодаря меди — большей твердостью и лучшими механическими свойствами.
Несмотря на сравнительную химическую устойчивость, серебро и золото могут подвергаться воздействию некоторых реактивов. Серебро, например, может реагировать с азотной кислотой, как с разбавленной, так и с концентрированной:
Ag + HNО3 → (Ag +1 ; N +4 ) (конц.)
Ag + HNО3 → (Ag +1 ; N +2 ) (разб.)
а также с концентрированной серной кислотой:
Ag + H2SО4 → (Ag +1 S +4 )
• Продукты реакции определите сами и найдите коэффициенты на основе электронного баланса.
Золото не реагирует с азотной кислотой. Отсутствие реакции при испытании золотого предмета азотной кислотой является подтверждением его состава. Однако смесь концентрированных азотной и соляной кислот под названием «царская водка» окисляет золото (см. § 72).
Ионы серебра Ag+1, попадая в раствор даже в ничтожно малых количествах, оказывают бактерицидное действие. Именно поэтому, например, очень долгое время может сохраняться так называемая «святая вода», которую священнослужители держат в серебряной посуде.
Из окислов следует отметить окись серебра Ag2О — вещество черного цвета, растворимое в аммиаке и проявляющее окислительные свойства особенно по отношению к некоторым органическим веществам.
Галогениды серебра, кроме фторида, в воде нерастворимы и несколько различаются между собой по цвету: хлорид — белый, бромид — желтоватый, иодид — желтый. Хлорид легко растворим в аммиаке. Бромид серебра особенно чувствителен к свету, как уже говорилось в § 42. Нитрат серебра AgNО3 широко применяется в химических лабораториях, а также в медицине в виде так называемого ляписа.
Соединения золота не имеют особого практического значения, поэтому мы на них останавливаться не будем.
В природе золото встречается в основном в самородном состоянии в виде песка, самородков. Серебро чаще всего встречается в виде сульфида Ag2S, получившего название «серебряный блеск». Соединения серебра часто сопутствуют другим металлам — меди, свинцу, сурьме и др.
■ 19. Почему при лечении зубов применяют в основном серебро и золото? (См. Ответ)
20. Почему серебро и золото причисляют к благородным металлам? Перечислите возможно более полно физические свойства этих металлов
21. Объясните процесс растворения золота в «царской водке» и напишите уравнения реакций.
22. Перечислите области применения серебра и золота. (См. Ответ)
Статья на тему Подгруппа меди



